La strada per il successo con la nostra gamma completa di servizi di test e audit a livello globale
I dispositivi medici vengono utilizzati per molti scopi diversi, dal trattamento di piccole ferite alle operazioni salvavita. A livello nazionale e internazionale è stato stabilito un complesso sistema di norme e regolamenti per garantire la sicurezza dei dispositivi. Per i fabbricanti può essere difficile tenere conto dei regolamenti specifici di ogni paese e dunque avere la sicurezza della conformità del loro prodotto in un mercato di destinazione.
Come Organismo fornitore di test e certificazione con grande esperienza nel campo dei dispositivi medici offriamo una vasta gamma di servizi per garantire la conformità dei tuoi prodotti nel mercato globale. Questi servizi includono:
Approvazioni internazionali in conformità ai requisiti dei mercati di Asia, Australia, Europa, Canada, Russia, USA e della regione del Sud America.
Approvazioni per l'Europa in conformità al nuovo Regolamento sui Dispositivi Medici 2017/745 (MDR) e al Regolamento Europeo sui Dispositivi Medici Diagnostici In Vitro 2017/746 (IVDR)
I nostri esperti possono vantare una consolidata esperienza sui requisiti dei diversi standard, regolamenti e ordinanze vigenti, e vi accompagneranno nel processo di accesso ai mercati nazionali e internazionali. I nostri esperti, i nostri auditor e i nostri laboratori di prova sono a tua disposizione, si nel tuo Paese che in tutto il mondo.
Le nostre sedi nel mondo per i servizi legati ai dispositivi medici
TÜV Rheinland è attiva in tutto il mondo con i propri laboratori, esperti e auditor, vicini ai clienti e alle loro attività. La mappa mostra i Paesi in cui sono presenti i nostri esperti e le in cui offriamo i nostri Servizi di Accesso al Mercato.
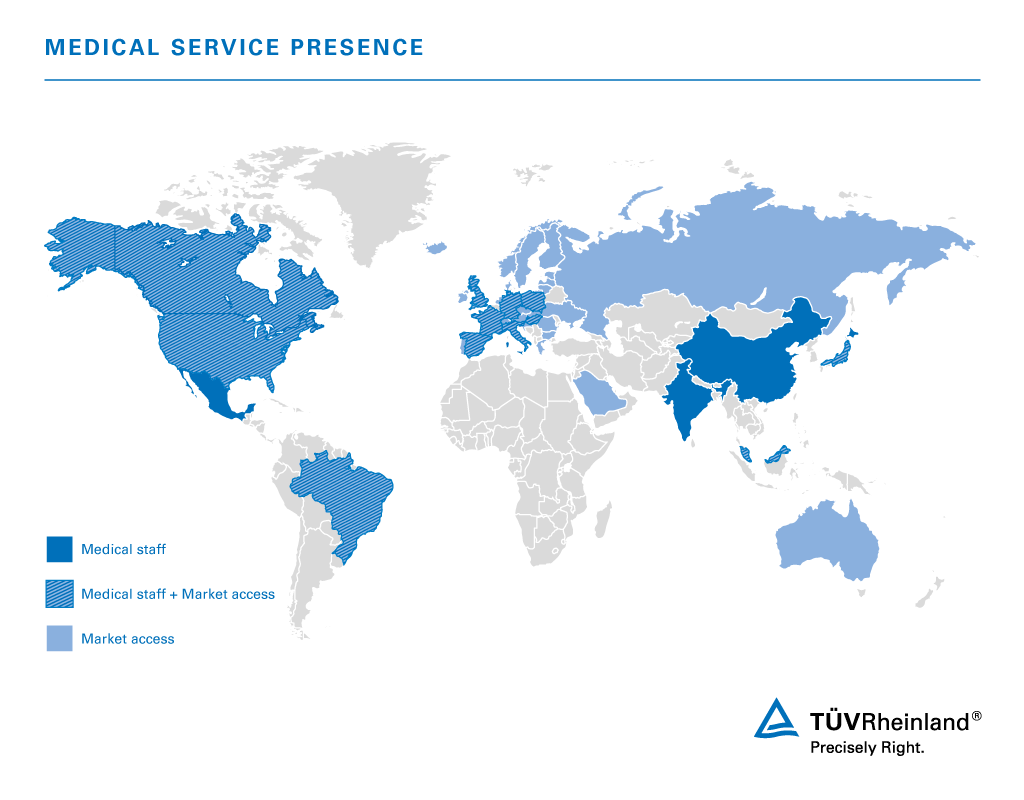
Con i suoi laboratori, esperti e auditor, TÜV Rheinland opera a livello globale ed è vicina ai clienti in ogni parte del mondo.
I nuovi regolamenti europei rappresentano una sfida per i produttori
Una delle principali sfide che devono attualmente affrontare i fabbricanti e i distributori di dispositivi medici è rappresentata dal nuovo Regolamento sui Dispositivi Medici (MDR) e dal nuovo Regolamento sulla Diagnostica In Vitro (IVDR), che sostituiscono le precedenti direttive MDD (93/42/CEE), AIMD (90/385/CEE) e IVDD (98/79/CE).
In Europa, le nuove MDR e IVDR stanno causando incertezze per quanto riguarda la certificazione dei dispositivi medici, soprattutto a causa dei tempi ristretti a disposizione. I fabbricanti devono di conseguenza verificare la validità di tutti i propri certificati di conformità , oltre a mobilitarsi per ottenere la certificazione di prodotti che in precedenza non rientravano nel campo di applicazione delle direttive sui dispositivi medici.


