グローバルな試験・監査サービスの包括的ポートフォリオで成功への道を切り拓く
医療機器は、小さな傷の治療から救命用途まで、さまざまな目的で使用されています。国際レベルでも国内レベルでも、機器の安全性を確保するために複雑な規則や規制のシステムが確立されています。各国固有の規制は、製造業者にとって監視が難しく、仕向け地に対し製品を適合させることが難しい場合があります。
医療機器分野で高い専門性を有する試験・認証機関として、テュフ ラインランドは世界市場向けの製品の適合性を確保するための幅広いサービスを提供しています。
アジア、オーストラリア、ヨーロッパ、カナダ、米国、南米地域の市場要件に特化した国際認証
新しい医療機器規則(MDR)2017/745および体外診断用医療機器に関する欧州規則(IVDR)2017/746、EN ISO 13485に基づく欧州向け認証
テュフ ラインランドは英国医療機器規制2002(SI 2002 No 618、改正後)(UK MDR)に基づく英国承認機関として正式に認定されています。
テュフ ラインランドの専門家は、適用される規格、条例、規制の要求事項に関して豊富な経験を有しており、お客様のターゲット市場への参入をサポートします。
医療機器関連サービスのグローバル拠点
テュフ ラインランドは、世界各地に試験所、専門家、審査員を配置しています。地図には、テュフ ラインランドの医療専門家が常駐している国や、医療機器のマーケットアクセスサービスがサポートする地域を示しています。
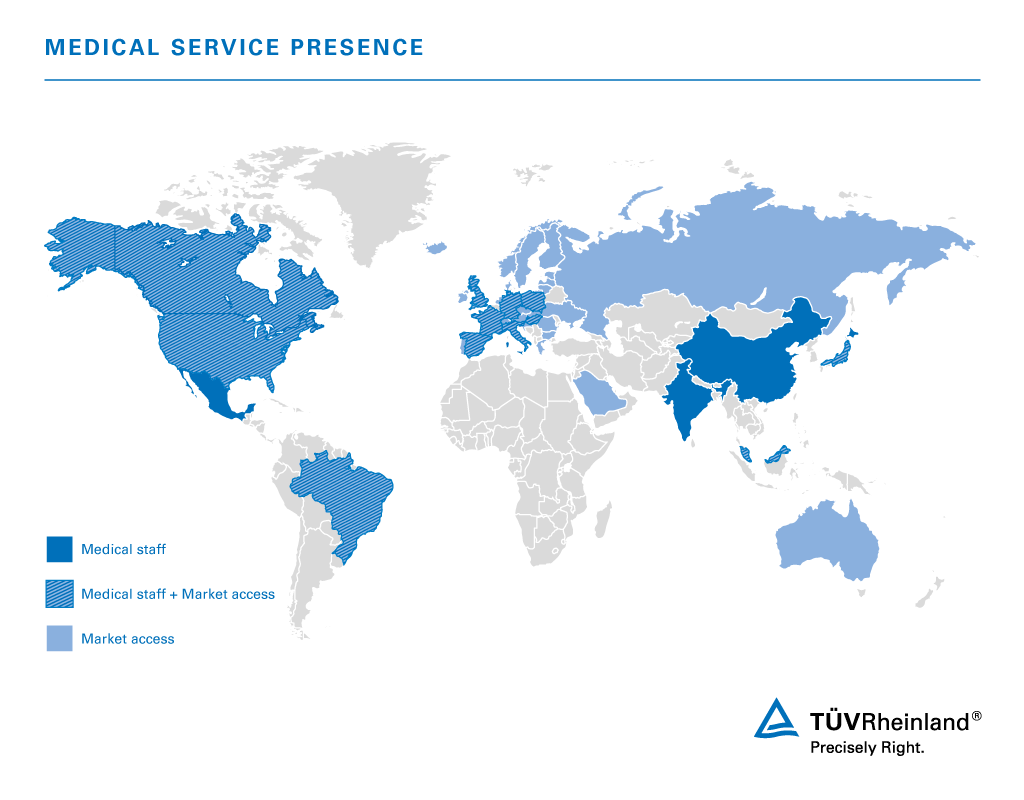
テュフ ラインランドはグローバルに事業を展開し、世界中どこでもお客様の近くでサポートします。
欧州規制対応への課題
グローバルな試験・監査サービスの包括的ポートフォリオで成功への道を切り拓く
医療機器の製造・販売業者が現在直面している最大の課題の一つは、新しい医療機器規則(MDR)と体外診断用医薬品規則(IVDR)です。これらは、従来の指令MDD (93/42/EEC)、AIMD (90/385/EEC)、IVDD (98/79/EC)に代わるものです。
欧州では、新しいMDRとIVDRに対応する時間が短いことが理由の一つであり、医療機器の認証が大きな課題となっています。製造業者は、既存の適合宣言の有効性をすべて検証しなければないうえ、以前は医療機器指令の範囲に含まれなかった製品の認証を実施する必要が生じています。
UKCA:英国マーケットアクセス

欧州連合(EU)離脱後、英国はすべての医療機器と体外診断用医療機器を英国市場に出すための法律として、医療機器規制2002(SI 2002 No 618、改正後)(UK MDR)を導入しました。
より高いクラスの医療機器の円滑な市場参入を実現するためには、英国承認機関との協力が必要です。また、市場参入に向けた製品の試験・認証には、業界を理解し、豊富な経験を持つパートナーを頼るべきです。
TUV Rheinland UK Ltd.は、UK MDRに基づく英国承認機関であり、市場参入に必要な専門知識を有しています。包括的な試験・認証サービスをワンストップで提供します。
UKCAマーク
現時点では、製造業者は医療機器、体外診断用医薬品、能動植込み型医療機器にCEマークを付けて英国市場に出すことができます。2023年6月、英国政府は医療機器の分類による移行期間を延長しました。しかし、移行終了時の遅延を避けるため、UKCA認証を受けることを強くお勧めします。
UKCAマークは、医療機器がUK MDRの要求事項に適合していることを証明するものです。適用される要求事項を定義するには、まず医療機器を分類し、適切な適合性評価手順を選択する必要があります。



