Ihr Erfolg mit unserem umfangreichen Portfolio an globalen Dienstleistungen für die Prüfung und Auditierung.
Bei medizinischen Behandlungen verlassen sich Patienten und Anwender auf die Qualität von Medizinprodukten. Ihre Einsatzgebiete sind vielfältig und reichen von der Versorgung kleiner Blessuren bis hin zu lebensrettenden Anwendungen. Daher ist es wichtig, dass Medizinprodukte die geforderten Standards zuverlässig erfüllen. International wie national soll ein komplexes System aus Regularien und Verordnungen die Sicherheit gewährleisten. Länderspezifische Regelungen machen es für Hersteller jedoch schwer den Überblick zu behalten und die Konformität ihres Produkts im Zielmarkt sicherzustellen.
Als Prüf- und Zertifizierungsorganisation mit hoher Expertise im Medizinproduktebereich bieten wir weitreichende Dienstleistungen an um Ihre Produkte für den weltweiten Markt konform zu machen. Dies sind unter anderem:
Internationale Zulassungen, die speziell auf die Erfordernisse der Vermarktung in Asien, Australien, Europa, Kanada, Südamerika und den USA abgestimmt sind.
Zulassungen für Europa, unter Berücksichtigung der neuen Medizinprodukteverordnung 2017/745 (MDR) und der Verordnung über In-vitro-Diagnostika 2017/746 (IVDR) , EN ISO 13485.
Jetzt neu! Zulassungen für das Vereinigte Königreich, als vollumfänglich zugelassene Stelle gemäß der britischen MDR 2002 in ihrer geänderten Fassung.
Unsere Experten sind mit den Anforderungen der geltenden Normen, Verordnungen und Regularien bestens vertraut und unterstützen Sie beim Zugang zu Ihren Zielmärkten. Mit unseren Experten, Auditoren und Prüflaboren sind wir weltweit für Sie da.
Erfahren Sie mehr über unsere Dienstleistungen für Medizinprodukte.

Branchendialog Medizinprodukte: Neue Wege in der Entwicklung und Zulassung.
Die Entwicklung von Medizinprodukten war schon immer eine anspruchsvolle Aufgabe. Neue Materialien, die Digitalisierung und der Einsatz von KI beschäftigen sicher auch Ihr Unternehmen. Bei unserem Branchendialog am 08. Oktober 2024 in Erlangen erwarten Sie spannende Vorträge und Diskussionen, bei denen wir Sie mit wichtigen Informationen und Erkenntnissen aus dem Alltag von Branchenexperten versorgen.
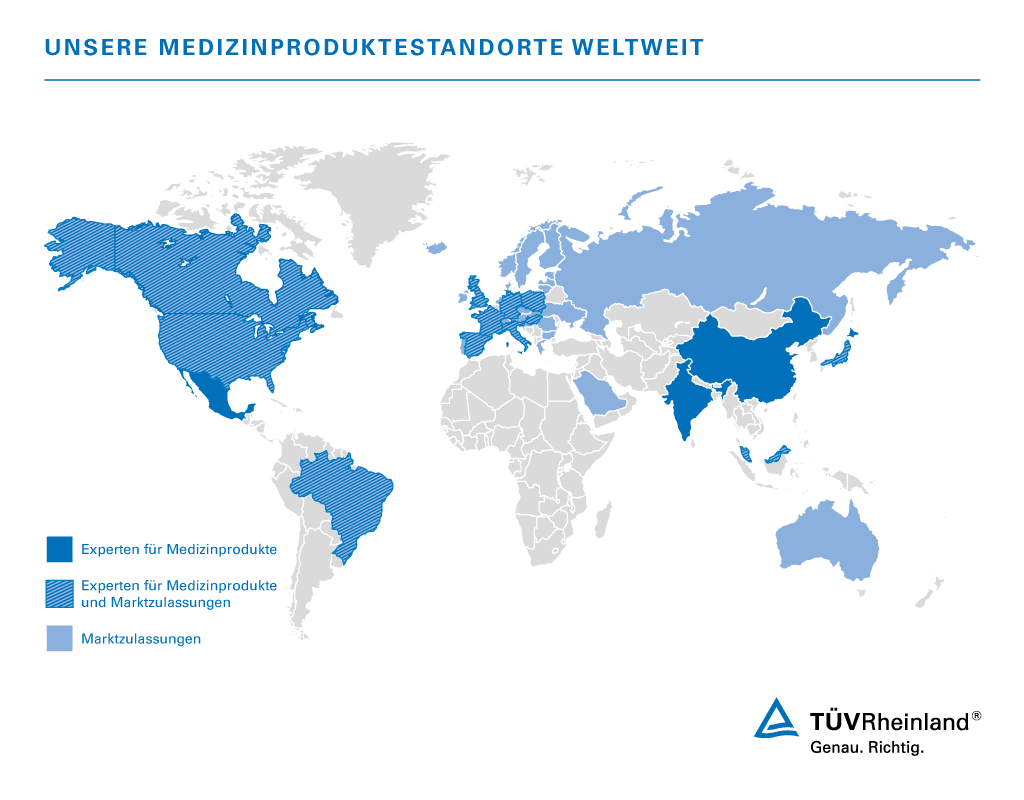
Unsere Medizinproduktestandorte weltweit
TÜV Rheinland ist mit eigenen Laboren, Experten und Auditoren weltweit aktiv und immer nah bei unseren Kunden. Die Grafik veranschaulicht, in welchen Regionen der Welt unsere Experten für Sie vor Ort sind und für welche Länder wir Sie bei Länderzulassungen von Medizinprodukten unterstützen können.
Neue Verordnungen in Europa werden zur Herausforderung für Hersteller
Eine der aktuell größten Herausforderungen für Hersteller und/ oder Inverkehrbringer von Medizinprodukten sind die neuen Verordnungen für Medizinprodukte (Medical Device Regulation, MDR) und In-vitro Diagnostika (In Vitro Diagnostics Regulation, IVDR). Diese ersetzen die bisherigen Richtlinien MDD (93/42/EWG), AIMD (90/385/EWG) und IVDD (98/79/EG).
In Europa sorgen die neuen Verordnungen MDR und IVDR insbesondere wegen des engen Zeitrahmens für Unsicherheit im Hinblick auf die Zertifizierungen im Medizinproduktebereich. Hersteller stehen vor der Herausforderung, die Gültigkeit aller bestehenden Konformitätserklärungen prüfen zu müssen und nun auch Zertifizierungen für Produkte durchzuführen, die bisher nicht unter die Medizinprodukte-Richtlinien fielen.
UKCA: Ihr Zugang zum Vereinigten Königreich

Nach dem Austritt aus der Europäischen Union führte das Vereinigte Königreich die Medizinprodukteverordnung 2002 (SI 2002 Nr. 618, in der geänderten Fassung) (UK MDR) als Gesetzgebung für das Inverkehrbringen aller Medizinprodukte und In-vitro-Diagnostika auf dem britischen Markt ein.
Um einen Markteintritt für höher klassige Medizinprodukte zu erreichen, ist eine Zusammenarbeit mit einer im Vereinigten Königreich zugelassenen Stelle , einem sogenannten UK Approved Body, erforderlich. Darüber hinaus sollten Sie sich auf einen Partner verlassen, der die Branche versteht und über umfangreiche Erfahrungen verfügt, um Ihr Produkt auf Marktreife zu prüfen und zu zertifizieren.
TUV Rheinland UK Ltd. ist ein von der MHRA zugelassener UK Approved Body für Medizinprodukte und verfügt über das Fachwissen, das Sie für den Markteintritt benötigen. Wir können Ihnen umfassende Prüf- und Zertifizierungsdienstleistungen aus einer Hand anbieten.
Das UKCA-Zeichen
Derzeit können Hersteller ihre Medizinprodukte, In-vitro-Diagnostika oder aktiven implantierbaren medizinischen Geräte noch mit dem CE-Zeichen auf dem britischen Markt in Verkehr bringen. Im Juni 2023 hat die britische Regierung die Übergangsfrist für Medizinprodukte in Abhängigkeit von ihrer Klassifizierung verlängert. Wir empfehlen Ihnen jedoch dringend, eine UKCA-Zertifizierung anzustreben, um Verzögerungen am Ende der Übergangszeit zu vermeiden.
Mit dem UKCA-Zeichen weisen Sie nach, dass Ihr Medizinprodukt die Anforderungen der britischen MDR erfüllt. Um die geltenden Anforderungen zu definieren, müssen Sie Ihr Produkt zunächst klassifizieren und das entsprechende Konformitätsbewertungsverfahren auswählen.
Wir unterstützen Sie bei der Umstellung auf die neuen Verordnungen zu Medizinprodukten und In-vitro Diagnostika.




